関連記事一覧

介護職員処遇改善加算、利用者向けリーフレット作成
利用料増の説明時に活用を、厚労省
利用料増の説明時に活用を、厚労省
★
★
★
★
★
3

課題山積のケアマネ 新たな検討会が初会合
業務範囲の整理・明確化を求める声相次ぐ
業務範囲の整理・明確化を求める声相次ぐ
★
★
★
★
★
3

施設などの世帯人員割合、85歳以上の女性で減少か
在宅への流れを反映 社人研
在宅への流れを反映 社人研
★
★
★
★
★
3

医師の地域偏在解消へ「具体的・包括的な政策」を検討―武見厚労相が表明
★
★
★
★
★
3
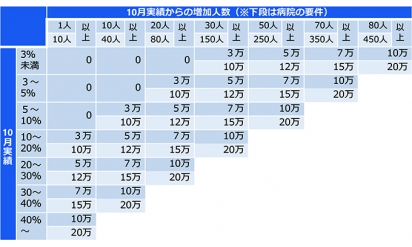
「マイナ保険証」利用促進策が見直し、診療所・薬局に最大10万円支援
★
★
★
★
★
3
![アストラゼネカ:気管支喘息治療薬「ファセンラ」、小児の難治患者に適応拡大[新薬開発・販売 FRONTLINE]](/files_thumbnail/ID4306_w412px_h247px.jpg)
アストラゼネカ:気管支喘息治療薬「ファセンラ」、小児の難治患者に適応拡大[新薬開発・販売 FRONTLINE]
★
★
★
★
★
3